Nitrosamine Verunreinigungen & Referenzstandards
Home » Chemische Dienstleistungen » Nitrosamine Verunreinigungen und kundenspezifische Referenzstandards
Ganzheitliches Risikomanagement von Nitrosaminverunreinigungen und Beratung pharmazeutischer Unternehmen bei der Prozessanpassung
- Ihre Produktbestandteile oder Ihr Herstellungsprozess könnten anfällig für die Bildung von Nitrosaminen sein ?
- Konformitätstests sind die letzte Chance, einen möglichen Marktrückruf oder eine Sperre Ihres Produkts zu verhindern ?
- Referenzstandards für die Reaktivitätsbewertung und das Risikomanagement sind kommerziell nicht verfügbar ?
- Sie benötigen eine Lösung aus einer Hand: von chemischer & analytischer Unterstützung sowie regulatorische Beratung ?
Aufgrund unserer langjährigen Expertise in Auftragssynthesen sowie begleitender Analytik und dem Umgang mit gefährlichen Substanzen (in einer Glovebox) konnten wir Pharmaunternehmen bei ihrer Risikobewertung und dem Risikomanagement von Nitrosaminverunreinigungen erfolgreich unterstützen. Nitrosamine können dabei als Verunreinigungen in Inhaltsstoffen, als Abbauprodukte oder im gesamten Herstellungsprozess identifiziert werden. Während andere Dienstleister meist nur Referenzstandards (z. B. Kataloganbieter) oder Analytik (analytische Prüflabore) anbieten, profitieren unsere Kunden von folgenden Dienstleistungen aus einer Hand:
- Customized reference standards for biological testing of nitrosamine impurities
- Qualitätskontrolle und Strukturbestätigung von synthetisierten Nitrosaminverbindungen
- Bestimmung der Nachweisgrenzen (LODs) von synthetischen Nitrosoabbauprodukten
- Ursachenanalyse zur Rückverfolgung aller Ausgangsmaterialien und Hilfsstoffe neben dem Wirkstoff
- Löslichkeitsstudien zur Unterstützung von Ames-Tests und Spülfaktoranalyse zum Verständnis von Strategieoptionen
- Stabilitätsstudien zur Unterstützung der Ames-Tests, Bewertung der Haltbarkeit und eingeführte Nitrosamine
- Stabilitätsstudien zur Unterstützung von Am es Tests, Bewertung der Lagerfähigkeit & eingeführte Nitrosamine
Nitrosaminverunreinigungen führen zu Arzneimittelrückrufen
Im Jahr 2018 wurde berichtet, dass einige Sartan-Arzneimittel mit Nitrosaminen kontaminiert sind. Daraufhin wurden Arzneimittelformulierungen, die verschiedene Sartane als pharmazeutische Wirkstoffe (APIs) enthielten, von verschiedenen Pharmaunternehmen zurückgerufen. Wichtige Aufsichtsbehörden haben eine Reihe von Arzneimitteln zurückgezogen, die Sartane, Ranitidin und Metformin enthalten.
Die offiziellen Leitlinien der FDA (Control of Nitrosamine Impurities in Human Drugs | FDA-2020-D-1530 aktualisiert im Februar 2021) und der EMA (NitrosamineVerunreinigungen in Humanarzneimitteln | EMEA/H/A-5(3)/1490, Juni 2020) raten Herstellern von Wirkstoffen und Arzneimitteln, unzulässige Mengen an Nitrosaminverunreinigungen in pharmazeutischen Produkten aufzudecken und zu verhindern. Diese Strategie umfasst die Risikobewertung (Schritt 1) aller Medikamente, die chemisch synthetisierte APIs enthalten, Konformitätstests, sobald Risiken identifiziert werden (Schritt 2), und die Meldung über geeignete Maßnahmen zur Verringerung/Verhinderung von Nitrosaminverunreinigungen (Schritt 3). Während die Risikobewertungen im März 2021 abgeschlossen sein sollten, erwartet die FDA den Abschluss der Konformitätstests und Meldungen im Oktober 2023, die Deadline der EMA liegt sogar im September 2022.
Diese Leitlinien gelten für alle chemisch synthetisierten Medikamente auf dem Markt und für solche, die noch einer aktuellen Begutachtung unterliegen. Da viele Inhaltsstoffe, Abbauprodukte und Herstellungsverfahren anfällig für die Bildung von N-Nitroso-Verbindungen sind, wird erwartet, dass sich diese wegweisenden Vorschriften schnell weiterentwickeln, um somit die Exposition des Menschen gegenüber Nitrosaminverunreinigungen zu begrenzen.
Sie haben Probleme mit Nitrosamine Verunreinigungen?
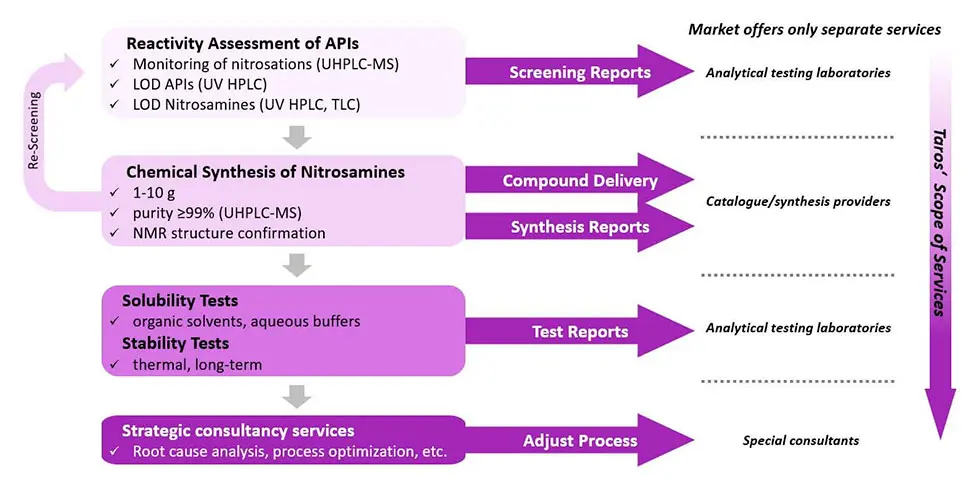
Unser Workflow für das Risikomanagement von Nitrosaminen
Zunächst etablieren wir ein Screening-Panel zur Bewertung der Reaktivität von Zielverbindungen wie z.B. APIs gegenüber der Nitrosierung bei verschiedenen Konzentrationen des Nitrosierungsmittels, Reaktionszeiten und Reaktionstemperaturen. Screening-Reaktionen werden parallel unter verschiedenen Bedingungen durchgeführt und mittels UHPLC-MS überwacht. Basierend auf den ersten Ergebnissen werden die Zielverbindungen klassifiziert und für die weitere Isolierung ausgewählt. Wenn eine Nitrosaminbildung vermutet, aber nicht zuverlässig nachgewiesen wird, wird ein erneutes Screening mit den synthetisierten Referenzstandards durchgeführt.
Die Nachweisgrenzen (LODs) der Zielverbindungen werden in UHPLC auf Basis von UV-Absorption bestimmt. Identifizierte Nitrosamine, die möglicherweise aus APIs mit sekundären und/oder tertiären Aminen gebildet werden können, werden abhängig von der Komplexität der Struktur in ausreichend großen Mengen synthetisiert. Gemäß relevanter Arzneibücher werden alle Verunreinigungen mit den gleichen strukturellen Voraussetzungen und dem Potenzial zur Bildung von Nitrosaminen mitsynthetisiert. Nitroso-Abbauprodukte werden mit einer Reinheit von ≥ 99 % in UHPLC isoliert und die Strukturen werden weiter durch NMR bestätigt. Die LODs synthetisierter Nitroso-Abbauprodukte werden schließlich mit Analysemethoden wie z.B. UHPLC-MS bestimmt.
Wir führen Löslichkeitstests (organische Lösungsmittel, wässrige Puffer) durch, um Ames-Tests sowie „Purge-Faktor-Analyse“ zu unterstützen, die entscheidend für das Verständnis von potentiellen Risiken und Kontrollstrategien ist. Stabilitätstests (thermisch, langfristig) werden ebenfalls im Rahmen der Ames-Tests durchgeführt, aber auch um z.B. die Haltbarkeit der untersuchten Verbindung zu evaluieren. Ein Abschlussbericht gibt neben der Risikobewertung und der Konformitätstests Empfehlungen für eine Folgestrategie und zur Anpassung des Prozesses.
FAQ @ Taros – Erfahren Sie mehr über Nitrosamine Verunreinigungen
Im Gegensatz zu reinen Analytiklabors oder Synthese- bzw. Kataloganbietern, bietet Taros Dienstleistungen aus einer Hand, von der Unterstützung der Risikobewertung und Konformitätstests von Nitrosaminverunreinigungen bis hin zur weiteren strategischen Beratung bzgl. chemischer und regulatorischer Fragen, um die Prozesse der Kunden gemäß den regulatorischen Richtlinien anzupassen . Als erfolgreiches Auftragsforschungsunternehmen (CRO) haben wir seit 1999 an Tausenden von Synthese- und Forschungsprojekten gearbeitet, einschließlich kundespezifischer Referenzstandards sowie dem Nachweis von Verunreinigungen für Pharma-, Biotech- und Chemieunternehmen. Wir verfügen über erfahrene Chemiker sowie die erforderliche Laborinfrastruktur und unterstützen Unternehmen bei ihrem Prozess der Reaktivitätsbewertung und des Risikomanagements von Nitrosaminverunreinigungen.
Wir verfolgen einen kundenorientierten Ansatz sowie ein flexibles Geschäftsmodell, um unsere Dienstleistungen innerhalb sehr enger Zeitvorgaben anspruchsvollen Herausforderungen in der Chemie zu widmen. Jedem Kunden wird ein eigener Projektmanager zugewiesen, um eine effektive und transparente Kommunikation über den Projektfortschritt sowie einen engen wissenschaftlichen Austausch zu gewährleisten und somit potentielle Probleme frühzeitig zu antizipieren. Da die ganzheitliche Risikobewertung und Konformitätstest von Nitrosaminen ein großes Unterfangen ist, verlassen sich Unternehmen auf einen kompetenten Partner wie Taros.
In jedem Fall sollten Sie unsere Chemiker kontaktieren, um so schnell wie möglich eine Lösung für Ihre Fragestellung zu erhalten – Jetzt Kontakt aufnehmen!
Aufsichtsbehörden wie die EMA und die FDA bewerten pharmazeutische Wirkstoffe und Arzneimittel auf Bildung und Kreuzkontamination von Nitrosaminen. Groß angelegte Produktrückrufe und Sperrungen könnten die Folgen sein.
Nach dem Nachweis und der quantitativen Bestimmung von N-Nitrosodimethylamin (NDMA) in Ranitidin fordert die EMA vorbeugende Maßnahmen wie eine Risikobewertung zur Bildung oder Anwesenheit von N-Nitrosamin in Arzneimitteln. Zulassungsinhaber (MAHs) sollten alle Arzneimittel überprüfen, um das Risiko von Nitrosaminverunreinigungen zu identifizieren und zu mindern. Wird positiv auf Nitrosamine positiv getestet, muss der MAH die Behörde informieren (unabhängig von der Menge). Der Fokus liegt auf Arzneimitteln und Inhaltsstoffen wie APIs sowie Hilfsstoffen, die zum Risikoprofil des Arzneimittels beitragen.
Aktuelle Beispiele für Nitrosamine in Arzneimitteln:
Valsartan: seit Juni 2018 weltweite Rückrufaktionen und CEP-Aussetzungen
Ibesartan, Losartan: seit Juli 2018 mehrere Rückrufe und CEP-Suspendierung
Pioglitazon HCL: seit April 2019 NDMA auf niedrigem Niveau, aber bisher keine Marktaktivitäten in der EU
Ranitidin: seit September 2019 mehrere Rückrufe (USA, EU) und Aussetzung der Marktzulassungen (EU, USA)
Metformin: seit Dezember 2019 Marktaktivitäten und Rückrufe (Darreichungsformen mit verlängerter Wirkstofffreisetzung)
Während die Risikobewertungen im März 2021 abgeschlossen sein sollten, erwartet die FDA den Abschluss der Konformitätstest und Meldungen im Oktober 2023. Die EMA erwartet sogar den Abschluss bis September 2022. Diese Leitlinien gelten für alle chemisch synthetisierten Medikamente auf dem Markt und solche, die einer aktuellen Begutachtung unterliegen.
Falls Sie weitere Fragen haben, unsere Chemiker besprechen gerne Ihre Fragestellungen – Jetzt Kontakt aufnehmen!
Neben Inhaltsstoffen eines Arzneimittels wie den APIs und Hilfsstoffen können Nitrosamine in vielen Produkten verschiedener Branchen gebildet werden, wie zum Beispiel:
- Agrochemie / Pflanzenschutzmittel
- TabakWaschmittel
- Lösungsmittel
- Kunststoffe
- Kosmetika
- und viele mehr
Kontaktieren Sie unser wissenschaftliches Business Development, wir beraten Sie gerne, um ein maßgeschneidertes Angebot zu erstellen – Jetzt Kontakt aufnehmen!
N-Nitrosamine können unter bestimmten Reaktionsbedingungen aus Aminen und Nitrosierungsmitteln (im Allgemeinen oxidierte stickstoffhaltige Verbindungen, NOx) gebildet werden. Diese NOx-Spezies haben unterschiedliche Reaktivitäten und können unterschiedlich mit Aminen reagieren, beispielsweise in Abhängigkeit vom pH-Wert der Reaktionsmedien und der Art des Lösungsmittels. Bei niedrigem pH-Wert sind die stärkeren Nitrosierungsreagenzien vorhanden, aber das Amin ist stärker protoniert und daher weniger reaktiv. Daher hängen wirksame Nitrosierungsbedingungen sowohl vom pH-Wert als auch von der Basizität des Amins ab. Salpetrige Säure bildet mit basischen Aminen Salze, die beim Erhitzen weiter zu N-Nitrosaminen reagieren können.
Es gibt verschiedene Wege für die Bildung von N-Nitroso-Verbindungen:
- N-N-Bindungsbildung
- N-O-Spaltung
- N-O-Bildung
- Verschiedene Wege, einschließlich verschiedener nitrosierender Reagenzien wie Peroxynitrit, Fremys Salz usw.
Kontaktieren Sie unser Wissenschaftliches Business Development, wir erstellen Ihnen gerne ein individuelles Angebot – Jetzt Kontakt aufnehmen!
Grundlegende Ursachen können sein:
- Allgemeine Bedingungen, die zur Bildung von Nitrosaminen führen.
Die Bildung ist in Gegenwart von sekundären, tertiären oder quartären Aminen und Nitritsalzen unter sauren Reaktionsbedingungen möglich. - Quellen sekundärer, tertiärer und quaternärer Amine, die Nitrosamine bilden können.
Amine können aus verschiedenen Gründen in einem Herstellungsverfahren vorhanden sein. Die API (oder API-Abbauprodukte), Zwischenprodukte oder Ausgangsmaterialien können sekundäre oder tertiäre funktionelle Amingruppen enthalten. - Kontamination in vom Lieferanten stammenden Rohstoffen.
- Kreuzkontaminationen durch unterschiedliche Prozesse, die auf derselben Linie laufen, und durch Anwenderbedingte Fehler wie unzureichende Phasentrennungen.
- Zurückgewonnene Lösungsmittel, Katalysatoren und Reagenzien als Kontaminationsquellen.
Wiedergewonnene Materialien wie Lösungsmittel, Reagenzien und Katalysatoren können aufgrund der Präsenz von Restaminen ein Risiko von Nitrosaminverunreinigungen darstellen. - Quenching als Quelle der Nitrosaminverunreinigung.
Es besteht die Gefahr der Nitrosaminbildung, wenn ein Quensching direkt in der Hauptreaktionsmischung durchgeführt wird (d. h. wenn salpetrige Säure zu der Reaktionsmischung gegeben wird, um restliches Azid zu zersetzen). - Fehlende Prozessoptimierung und -steuerung.
Falls Reaktionsbedingungen wie Temperatur, pH-Wert oder die Reihenfolge der Zugabe von Reagenzien, Zwischenprodukten oder Lösungsmitteln ungeeignet oder schlecht kontrolliert sind.
Kontaktieren Sie unser wissenschaftliches Business Development, wir beraten Sie gerne zu Ihren spezifischen Anforderungen – Jetzt Kontakt aufnehmen!
Bisher haben die Aufsichtsbehörden nur Wirkstoffe und Arzneimittel auf die Bildung und Kreuzkontamination von Nitrosaminen untersucht. Es gibt keine regulatorischen oder Testanforderungen für den Hilfsstoffhersteller, um die Bildung von Nitrosaminen in Hilfsstoffen zu beurteilen.
Da Hilfsstoffe jedoch Bestandteile des Arzneimittels sind, sind sie ebenfalls Bestandteil der Arzneimittelrisikobewertung. Die FDA äußert bereits Bedenken hinsichtlich der Präsenz von Nitriten als Nitrosierungsmittel. Nitritverunreinigungen können auch je nach Hilfsstoffcharge und Lieferant variieren. Das potenzielle Vorhandensein von Nitriten kann ein Risiko für die Bildung von Nitrosaminen in verschiedenen Stadien darstellen:
- Während des Herstellungsprozesses von Arzneimitteln
- Während der gesamten Haltbarkeitsdauer
- Wenn die nitrosierbare Struktur mit einer anderen Komponente/Verunreinigung des Arzneimittels vorhanden ist
Sogar die Verwendung bestimmter Verpackungsmaterialien kann eine Quelle für Nitrosamine sein (Eine Nitrosamin-Kontamination wurde in einem in Blister gelagerten Endprodukt beobachtet. Der Inhaber der Genehmigung für das Inverkehrbringen hat die Hypothese aufgestellt, dass die Deckelfolie, die Nitrozellulose-Druckgrundierung enthält, mit den Amine in Druckfarben zu Nitrosaminen reagiert, die unter bestimmten Verpackungsprozessbedingungen auf das Produkt übertragen würden).
Deshalb unsere Empfehlung: Kontaktieren Sie unsere Chemiker, wir erklären Ihnen gerne unsere Möglichkeiten im Detail – Jetzt Kontakt aufnehmen!
Die FDA hat sieben Nitrosaminverunreinigungen identifiziert, die in chemisch synthetisierten Wirkstoffen und Arzneimitteln vorhanden sein können. Die ersten fünf wurden bereits in vermarkteten Arzneimitteln nachgewiesen. Während die letzten beiden bisher nicht nachgewiesen wurden, halten Experten ihre Anwesenheit für sehr wahrscheinlich. Die FDA hat vorläufige Grenzwerte (Acceptable Intake Limits) für sechs dieser Nitrosaminverunreinigungen vorgeschlagen (siehe Tabelle unten).
| Nitrosamine | Acceptable Intake Limits (ng/Tag) |
| N-nitrosodimethylamine (NDMA) | 96 |
| N-nitrosodiethylamine (NDEA) | 26.5 |
| N-nitroso-N-methyl-4-aminobutanoic acid (NMBA) | 96 |
| N-nitrosomethylphenylamine (NMPA) | 26.5 |
| N-nitrosoisopropylethyl amine (NIPEA) | 26.5 |
| N-nitrosodiisopropylamine (NDIPA) | 26.5 |
| N-nitrosodibutylamine (NDBA) | unspecified |
Die Europäische Arzneimittelagentur (EMA) hat für Sartan-Produkte basierend auf der maximalen Tagesdosis vorübergehende Übergangsgrenzwerte für NDMA, NDEA, NMBA, NDIPA und NEIPA festgelegt.
Der einfachste Weg zu verstehen welche Bandbreite an Mehrwerten Taros Ihnen bieten kann ist, indem Sie unser wissenschaftliches Business Development kontaktieren – Jetzt Kontakt aufnehmen!
Medizinalchemie
Wirkstoffforschung
Das internationale Team von Taros verfügt kombiniert über mehr als 180 Jahre Erfahrung in der pharmazeutischen F&E. Als Team haben wir an mehr als 120 biomolekularen…

Performance Chemicals
Materialwissenschaft
Wir entwickeln mit Ihnen Performance Chemicals zur Verbesserung Ihrer Materialien, Kunststoffe, Beschichtungen, Farbstoffe und Druckfarben…

Interessiert?
Als ein europaweit führendes und unabhängiges Auftragsforschungsunternehmen (CRO) bieten wir Ihnen das gesamte Spektrum der (metall)organischen Synthesechemie.
Wir praktizieren einen pragmatischen sowie kundenorientierten Ansatz, um die Erwartungen an uns trotz höchster Herausforderungen zu übertreffen. Unsere erfahrenen Chemiker sind geschult, wirtschaftliche, ökologische sowie sicherheitstechnische Bedingungen für alle Phasen des Projekts zu evaluieren.